デュタステリドカプセル0.5mgZA「AFP」
医薬品情報
| 総称名 | デュタステリド |
| 一般名 | デュタステリド |
| 欧文一般名 | Dutasteride |
| 製剤名 | デュタステリドカプセル |
| 薬効分類名 | 5α還元酵素1型/2型阻害薬, 男性型脱毛症治療薬 |
| 薬効分類番号 | 2499 |
| ATCコード | G04CB02 |
| KEGG DRUG | D03820 デュタステリド 商品一覧 米国の商品 相互作用情報 |
| JAPIC | 添付文書(PDF) |
添付文書情報 2021年5月 作成 (第1版)
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| デュタステリドカプセル0.5mgZA「AFP」 | DUTASTERIDE Capsules 0.5mgZA「AFP」 | 東洋カプセル | 249900AM2100 | 劇薬 , 処方箋医薬品 |
禁忌
次の患者には投与しないこと
本剤の成分及び他の5α還元酵素阻害薬に対し過敏症の既往歴のある患者
女性[「重要な基本的注意」及び「妊婦、産婦、授乳婦等への投与」の項参照]
小児等[「重要な基本的注意」及び「小児等への投与」の項参照]
重度の肝機能障害のある患者[本剤は主に肝臓で代謝されるため、血中濃度が上昇するおそれがある(「慎重投与」の項参照)。]
効能・効果及び用法・用量
効能効果
男性における男性型脱毛症
効能効果に関連する使用上の注意
男性における男性型脱毛症のみの適応である。他の脱毛症に対する適応はない。
20歳未満での安全性及び有効性は確立されていない。
用法用量
男性成人には、通常、デュタステリドとして0.1mgを1日1回経口投与する。なお、必要に応じて0.5mgを1日1回経口投与する。
用法用量に関連する使用上の注意
カプセルの内容物が口腔咽頭粘膜を刺激する場合があるので、カプセルは噛んだり開けたりせずに服用させること。
投与開始後12週間で改善が認められる場合もあるが、治療効果を評価するためには、通常6ヵ月間の治療が必要である。
本剤を6ヵ月以上投与しても男性型脱毛症の改善がみられない場合には投薬を中止すること。また、6ヵ月以上投与する場合であっても定期的に効果を確認し、継続投与の必要性について検討すること。
使用上の注意
慎重投与
肝機能障害のある患者[本剤は主に肝臓で代謝され、半減期は約3〜5週間である。肝機能障害のある患者に投与した場合の薬物動態は検討されていない。]
重要な基本的注意
本剤は経皮吸収されることから、女性や小児はカプセルから漏れた薬剤に触れないこと。漏れた薬剤に触れた場合には、直ちに石鹸と水で洗うこと(「妊婦、産婦、授乳婦等への投与」及び「小児等への投与」の項参照)。
本剤は、血清前立腺特異抗原(PSA)に影響を与えるので、前立腺癌等の検査に際しては、以下の点に注意すること。また、PSAの検査を受ける際には本剤の服用について検査を行う医師に知らせるよう、患者を指導すること。
PSA値は、前立腺癌のスクリーニングにおける重要な指標である。一般に、PSA値が基準値(通常、4.0ng/mL)以上の場合には、更なる評価が必要となり、前立腺生検の実施を考慮に入れる必要がある。なお、本剤投与中の患者で、本剤投与前のPSA値が基準値未満であっても、前立腺癌の診断を除外しないように注意すること。
本剤投与6ヵ月以降のPSA値を新たなベースラインとし、その後は適宜PSA値を測定してベースラインからの変動を評価すること。
デュタステリドは、前立腺肥大症患者に0.5mg/日投与した場合、前立腺癌の存在下であっても、投与6ヵ月後にPSA値を約50%減少させる。したがって、本剤を6ヵ月以上投与している患者のPSA値を評価する際には、測定値を2倍した値を目安として基準値と比較すること。また、PSA値は、本剤投与中止後6ヵ月以内に本剤投与開始前の値に戻る。なお、男性型脱毛症患者においても、臨床試験の結果から、本剤投与によりPSA値が減少すると推測される。
本剤投与中におけるPSA値の持続的増加に対しては、前立腺癌の発現や本剤の服薬不遵守を考慮に含め、注意して評価すること。
本剤投与中において、free/total PSA比は一定に維持されるので、前立腺癌のスクリーニングの目的で%free PSAを使用する場合には、測定値の調整は不要である。
相互作用
相互作用序文
本剤は、主としてCYP3A4で代謝される。
薬物代謝酵素用語
併用注意
|
CYP3A4阻害作用を有する薬剤
リトナビル等
|
これらの薬剤との併用により本剤の血中濃度が上昇する可能性がある。 | CYP3A4による本剤の代謝が阻害される。 |
副作用
副作用発現状況の概要
本剤は使用成績調査等の副作用発現頻度が明確となる調査を実施していない。
重大な副作用及び副作用用語
重大な副作用
(頻度不明)
肝機能障害、黄疸
AST(GOT)、ALT(GPT)、ビリルビンの上昇等を伴う肝機能障害や黄疸があらわれることがあるので、観察を十分に行い、異常が認められた場合には、投与を中止するなど、適切な処置を行うこと。
その他の副作用
| 頻度不明 | |
| 過敏症 | 発疹、蕁麻疹、アレルギー反応、そう痒症、限局性浮腫、血管浮腫 |
| 精神神経系 | 頭痛、抑うつ気分、浮動性めまい、味覚異常 |
| 生殖系及び乳房障害 | 性機能不全(リビドー減退、勃起不全、射精障害)、乳房障害(女性化乳房、乳頭痛、乳房痛、乳房不快感)、精巣痛、精巣腫脹 |
| 皮膚 | 脱毛症(主に体毛脱落)、多毛症 |
| 消化器 | 腹部不快感、腹痛、下痢 |
| その他 | 倦怠感、血中クレアチンホスホキナーゼ増加 |
妊婦、産婦、授乳婦等への投与
女性には投与しないこと。[ラット及びウサギにデュタステリドを経口投与した結果、雄胎児の外生殖器の雌性化がみられ、本剤の曝露により血中ジヒドロテストステロンが低下し、男子胎児の外生殖器の発達を阻害する可能性が示唆された。]
本剤が乳汁中に移行するかは不明である。
小児等への投与
小児等には投与しないこと。[小児等に対する適応はなく、安全性及び有効性は確立されていない。]
過量投与
徴候・症状
健康成人男性にデュタステリドを最大40mg1日1回7日間投与した臨床試験において、重大な安全性上の問題は認められなかった。また、前立腺肥大症患者にデュタステリド5mgを1日1回6ヵ月間投与した臨床試験で認められた副作用は、デュタステリド0.5mg投与時に認められたものと同様であった。
処置
デュタステリドに特有の解毒剤はない。過量投与の場合には、必要に応じて適切な支持療法を行うこと。
適用上の注意
薬剤交付時
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。[PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔を起こして縦隔洞炎等の重篤な合併症を併発することが報告されている。]
その他の注意
海外臨床試験において、18〜52歳の健康成人(デュタステリド群:27例、プラセボ群:23例)を対象に、52週間の投与期間及び24週間の投与後追跡期間を通して、デュタステリド0.5mg/日の精液特性に対する影響を評価した。投与52週目における総精子数、精液量及び精子運動率の投与前値からの平均減少率(プラセボ群の投与前値からの変化で調整)は、それぞれ23、26及び18%であり、精子濃度及び精子形態への影響は認められなかった。デュタステリド群における総精子数の投与前値からの平均減少率は、24週間の追跡期間後においても23%のままであった。しかしながら、いずれの評価時期においても、全ての精液パラメータの平均値は正常範囲内であり、事前に規定した臨床的に重要な変動(30%)には至らなかった。また、デュタステリド群の2例において、投与52週目に投与前値から90%を超える精子数の減少が認められたが、追跡24週目には軽快した。デュタステリドの精液特性に及ぼす影響が、個々の患者の受胎能に対しどのような臨床的意義をもつかは不明である。
アカゲザルの器官形成期にデュタステリドを2010ng/匹/日まで静脈内投与した結果、2010ng/匹/日群(デュタステリドを服用した男性の精液5mLを介して100%吸収されると仮定した場合に、体重50kgの女性が曝露される推定最大曝露量の186倍に相当する)の雌胎児1例に、本薬投与との関連性は不明であるが、卵巣・卵管の不均衡発達が認められた。
ラットのがん原性試験において、高用量(臨床用量における曝露量の約141倍)投与時に精巣間細胞腫の増加がみられた。しかしながら、精巣間細胞腫及び過形成の発現に起因するラットの内分泌機構のヒトへの外挿性が低いことから、ヒトに精巣間細胞腫を発現させる危険性は低いと考えられている。なお、マウスのがん原性試験においては、デュタステリドに関連すると考えられる腫瘍の発生は認められなかった。
デュタステリドを投与された前立腺肥大症患者で男性乳癌が報告されている。デュタステリドと男性乳癌の発現との関連性は不明である。なお、前立腺肥大症患者を対象とした2〜4年間の海外臨床試験(4325例)において3例の乳癌が報告された。このうち、デュタステリドが投与された症例では2例(曝露期間10週間、11ヵ月)、プラセボのみが投与された症例では1例報告されている。国内臨床試験での報告はない。
白人を主体とした50〜75歳の男性8231例(生検により前立腺癌が陰性かつPSA値2.5〜10.0ng/mL)を対象とした4年間の国際共同試験(日本人57例を含む)において、Modified Gleason Score*8〜10の前立腺癌の発現率がプラセボ群(0.5%)に対しデュタステリド群(1.0%)において高かった(相対リスク2.06[95%信頼区間:1.13-3.75])との報告がある1)2)3)。
*組織学的悪性度の指標
薬物動態
生物学的同等性試験
デュタステリドカプセル0.5mgZA「AFP」と標準製剤を、クロスオーバー法によりそれぞれ1カプセル(デュタステリド0.5mg)を健康成人男性に絶食単回経口投与し、血漿中濃度を測定した。得られた薬物動態パラメータ(AUC、Cmax)について統計解析を行った結果、両製剤の生物学的同等性が確認された4)。
| Cmax(ng/mL) | Tmax(hr) | T1/2(hr) | AUC0-192hr(ng・hr/mL) | |
| デュタステリドカプセル0.5mgZA「AFP」 | 2.9±0.8 | 2.6±1.1 | 55.7±33.1 | 112.6±54.0 |
| 標準製剤(カプセル、0.5mg) | 2.9±0.8 | 2.6±1.2 | 56.8±27.2 | 118.0±57.1 |
(Mean±S.D.,n=31)
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
薬効・薬理
テストステロンからより作用の強いジヒドロテストステロンへと変換する1型と2型5α-還元酵素の両型を阻害する。男性の二次性徴発現はジヒドロテストステロンで起こり、毛根に働き男性型脱毛を生ずる5)。
有効成分に関する理化学的知見
| 一般名 | デュタステリド |
| 一般名(欧名) | Dutasteride |
| 化学名 | N-[2,5-Bis(trifluoromethyl)phenyl]-3-oxo-4-aza-5α-androst-1-ene-17β-carboxamide |
| 分子式 | C27H30F6N2O2 |
| 分子量 | 528.53 |
| 性状 | 本品は白色〜微黄色の結晶性の粉末又は粉末である。 |
| KEGG DRUG | 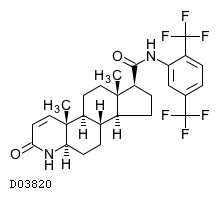 |
取扱い上の注意
本剤は経皮吸収されることから、女性や小児はカプセルから漏れた薬剤に触れないこと。漏れた薬剤に触れた場合には、直ちに石鹸と水で洗うこと。
安定性試験
PTP包装したものを用いた加速試験(40℃、75%RH、6ヵ月)の結果、通常の市場流通下において3年間安定であることが推測された。
包装
デュタステリドカプセル0.5mgZA「AFP」
30カプセル(PTP:10カプセル×3)
主要文献
作業情報
| 改訂履歴 | 2021年5月 作成 (第1版) |
| 文献請求先 | 主要文献に記載の社内資料につきましても下記にご請求下さい。 アルフレッサファーマ株式会社 540-8575 大阪市中央区石町二丁目2番9号 06-6941-0306 |
| お問い合わせ先 | 主要文献に記載の社内資料につきましても下記にご請求下さい。 アルフレッサファーマ株式会社 540-8575 大阪市中央区石町二丁目2番9号 06-6941-0306 |
| 業態及び業者名等 | 販売元 アルフレッサファーマ株式会社製造販売元 東洋カプセル株式会社 静岡県富士宮市中里東町560 |